疾病控制率高达100%!国研单抗ASKB589初战告捷
ASKB589是AskGene研发的一种创新生物药物,它是一种针对CLDN18.2的重组人源化单克隆抗体。该药物通过与表达CLDN18.2的癌细胞高亲和力结合,介导抗体依赖性细胞介导的细胞毒作用(ADCC)和补体依赖性细胞毒作用(CDC)。ASKB589旨在治疗G/GEJ癌、胰腺癌以及表达CLDN18.2的其他癌症类型。
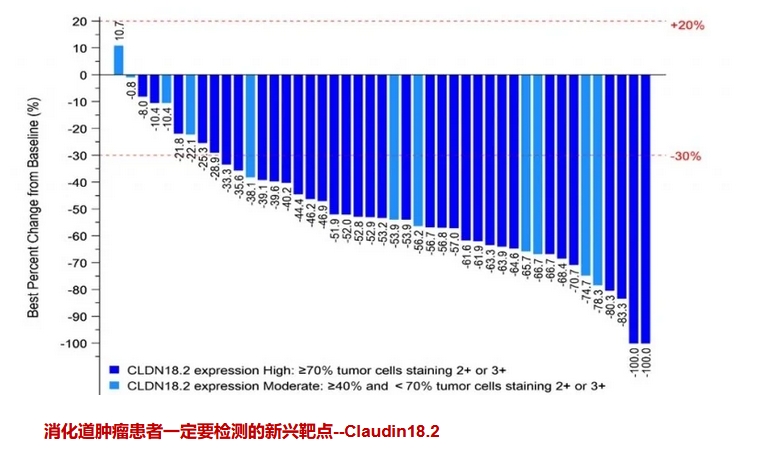
2024年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCOGI)上公布了这款国研药物的鼓舞人心的最新数据。ASKB589联合化疗(CAPOX)和PD-1抑制剂作为局部晚期、复发和转移性胃(G)或胃食管连接部(GEJ)腺癌患者的一线治疗,疾病控制率高达100%!
截至2023年12月20日,共有62名CLDN18.2表达阳性的晚期胃癌患者接受了ASKB589联合CAPOX和PD-1抑制剂治疗。
结果显示:客观缓解率(ORR)高达80%(36名)患者达到部分缓解,肿瘤病灶显著缩小30%以上,还有2名幸运的患者肿瘤靶病灶完全消失!9名(20.0%)患者达到疾病稳定,整体疾病控制率高达100%,这意味着所有患者的肿瘤靶病灶都出现了不同程度的缩小或控制稳定!
消化道肿瘤患者一定要检测的新兴靶点--Claudin18.2
相信这款药物一定让胃癌患者感到鼓舞人心,需要病友们一定要知道的是,Claudin18.2是一个泛肿瘤的靶点,在多种上皮肿瘤当中都有表达,尤其在消化系统肿瘤中(如胃癌、胃食管结合部癌、食管癌和胰腺癌)异常过表达,比如,在胃癌或胃食管结合部癌中,在高达70%-80%的胃癌或胃食管结合部癌患者,以及60%的胰腺癌患者可检测到Claudin18.2的高度表达,成为近两年最具潜力的热门靶点。因此确诊胃癌、食管癌、胰腺癌等消化道肿瘤后,除了检测HER2,PD-L1,MET等靶点,一定要检测下Claudin18.2。
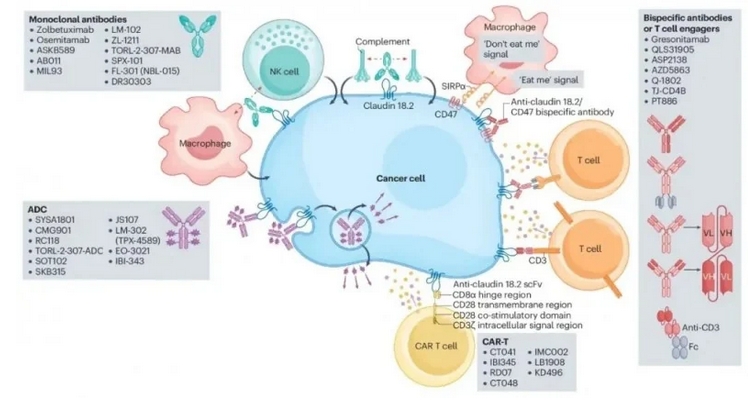
目前Claudin18.2作为极具前景的肿瘤靶向治疗靶点,国际国内20多家药企布局了claudin18.2靶向药物的临床开发,包括claudin18.2单抗、双抗药物、ADC和CAR-T等。








